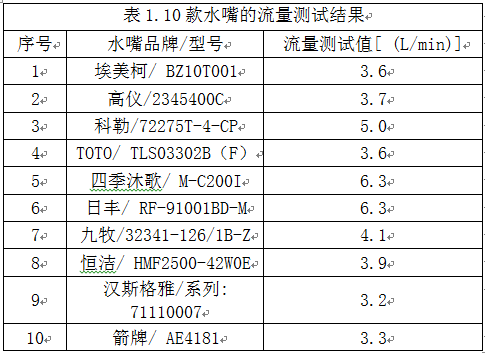
2017年,当世界首批消除内源性逆转录病毒的基因编辑“猪1.0”诞生时,领衔该研究的美国eGenesis公司联合创始人杨璐菡告诉新华社记者,希望将来“在中国建立中国人自主研发的机构,致力于为中国病人研发异种器官移植的治疗手段”。
时隔三年,杨璐菡归国后组建的杭州启函生物公司领衔团队9月21日在英国《自然·生物医学工程》杂志上宣布,有望用于临床的异种器官移植雏形——“猪3.0”问世,并成功解决了去除猪内源性逆转录病毒和增强异种器官免疫相容性两大异种移植安全性难题,这让她和团队距离实现“人人用得上”的异种器官移植梦想更近一步。
兼容性更强,基因编辑“猪3.0”顺利诞生
持续至今的新冠疫情让全球科研受到干扰。对杨璐菡来说,疫情虽导致原有的一些国际学术活动被迫取消,却给团队更多时间专注于科研,并通过比此前更加密集的线上会议与国际同行交流。
“生物行业不像别的行业,大家的‘敌人’不是彼此,而是新冠病毒、是癌症、是器官缺失。这是一个全球性课题,我们绝不会闭门造车,而是希望和国际优秀科学家、医生和监管机构保持紧密沟通,这样才能做出全世界都认可的领先产品。”杨璐菡日前接受新华社记者采访时说。就在刚刚过去的一周,为参与国际会议,团队成员已连续熬了几个通宵。
不负夜以继日的努力,基因编辑“猪1.0”的升级版——“猪3.0”顺利诞生。参与研究的还有云南农业大学、美国哈佛大学、马萨诸塞综合医院、eGenesis公司等。研究人员利用CRISPR/Cas9基因敲除技术和转座子基因插入技术修改了猪的一批基因位点,培育出的猪体内不含内源性逆转录病毒,与人之间免疫和凝血方面兼容性更强,并具有正常生理特征、生育能力以及向下一代传递编辑基因的能力。
2017年,哈佛大学医学院遗传学教授乔治·丘奇和杨璐菡团队在美国《科学》杂志上宣布培育出世界首批不携带内源性逆转录病毒的“猪1.0”,从根本上解决了猪器官移植到人体内可能导致病毒传染的风险。2018年,“猪2.0”诞生,进一步解决了异种器官移植免疫排斥问题。新诞生的“猪3.0”结合了前两代优势,更具临床应用潜力。
最新研究显示,在体外免疫测试中已区别不出“猪3.0”细胞和人细胞,显示出很好的免疫兼容性。论文通讯作者杨璐菡介绍,团队正在灵长类动物身上测试“猪3.0”器官的有效性和安全性,已取得一些“让人激动的阶段性成果”。
“全球每年器官移植缺口巨大,再加上程序、价格以及质量的不均一性,只有少数人排得上。我们的梦想是,未来的器官治疗产品不论贫富贵贱,人人都能用得上。”杨璐菡说。
据介绍,目前团队主要利用“猪3.0”进行肾脏、肝脏和胰岛的异种器官移植实验,希望将来能满足尿毒症、急性肝炎和糖尿病患者的器官移植需求。马萨诸塞综合医院移植科主任詹姆斯·马尔克曼表示,相关研究为数以百万计等待器官移植的病人带来了希望。
技术难题仍在,异种器官移植之路还很远
据不完全统计,每年全球约有200万人需要器官移植,而器官捐献数量远低于需求。异种器官移植研究成为解决“移植器官荒”的重要途径,但同时面临异种病毒传播、免疫兼容性和功能兼容性三大技术难点。
猪的器官组织结构、生理功能和大小与人体器官相近,被视为异种器官移植供体最佳动物之一。但是将猪器官移植到人体面临两大医疗风险:猪的基因组携带内源性逆转录病毒,移植到人体后可能有“毒性”;猪器官可能在患者体内引发免疫排斥反应。
内源性逆转录病毒异种传播风险已随着“猪1.0”的诞生而被“攻破”,针对免疫兼容性的研究也不断取得进展。2019年,巴西圣保罗大学生物科学研究所利用基因编辑技术试图关闭猪体内3个能引起人体排异反应的基因,旨在消除人体免疫系统对猪器官的排异。
功能兼容性问题是尚待解决的技术挑战,被移植的猪器官能否完全发挥原有人体器官维持荷尔蒙分泌、代谢平衡等功能仍有待检验。
杨璐菡说,解决“供体猪”的异种病毒传播风险和免疫兼容性只是“万里长征第一步”,目前团队正在不停摸索和改进功能上的兼容性,例如观察被移植猪肾的灵长类动物是否能通过肾素的分泌保持水盐平衡稳定等。
即使技术难题得以攻破,未来在商业化道路上,异种器官移植仍面临伦理、监管等诸多挑战。比如,如何权衡用于器官供应的动物伦理?如何适当监管以引导有关机构负责任而又积极地发展技术?
“技术进步往往超前于监管、伦理规范及民众认知。作为科研工作者和技术推动者,我们有责任很好地思考这些问题,并跟大家分享我们思考的逻辑。所有技术进步,能否应用到某些场景和在什么情况下可以应用到这些场景,必须通过持续探讨才能形成有益框架,真正推动技术改变社会。”杨璐菡说。
关键词: 异种器官移植离























 营业执照公示信息
营业执照公示信息